El proceso de replicación de ADN es el mecanismo que permite al ADN duplicarse (es decir, sintetizar una copia idéntica). De esta manera de una molécula de ADN única, se obtienen dos o más “clones” de la primera. Esta duplicación del material genético se produce de acuerdo con un mecanismo semiconservador, lo que indica que las dos cadenas complementarias del ADN original, al separarse, sirven de molde cada una para la síntesis de una nueva cadena complementaria de la cadena molde, de forma que cada nueva doble hélice contiene una de las cadenas del ADN original. Gracias a la complementariedad entre las bases que forman la secuencia de cada una de las cadenas, el ADN tiene la importante propiedad de reproducirse idénticamente, lo que permite que la información genética se transmita de una célula madre a las células hijas y es la base de la herencia del material genético.
La molécula de ADN se abre como una cremallera por ruptura de los puentes de hidrógeno entre las bases complementarias liberándose dos hebras y la ADN polimerasa sintetiza la mitad complementaria añadiendo nucleótidos que se encuentran dispersos en el núcleo. De esta forma, cada nueva molécula es idéntica a la molécula de ADN inicial.
La replicación empieza en puntos determinados: los orígenes de replicación. Las proteínas iniciadoras reconocen secuencias de nucleótidos específicas en esos puntos y facilitan la fijación de otras proteínas que permitirán la separación de las dos hebras de ADN formándose una horquilla de replicación. Un gran número de enzimas y proteínas intervienen en el mecanismo molecular de la replicación, formando el llamado complejo de replicación o replisoma. Estas proteínas y enzimas son homólogas en eucariotas y arqueas, pero difieren en bacterias.
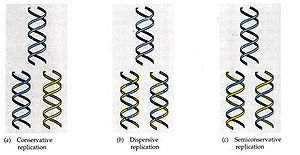
Semiconservadora
En cada una de las moléculas hijas se conserva una de las cadenas originales, y por eso se dice que la replicación del ADN es semiconservadora. Hasta que finalmente se pudo demostrar que la replicación es semiconservadora, se consideraron tres posibles modelos para el mecanismo de la replicación:
* Semiconservadora (modelo correcto). En cada una de las moléculas hijas se conserva una de las cadenas originales.
* Conservadora. Se sintetiza una molécula totalmente nueva, copia de la original.
* Dispersora, o dispersante. Las cadenas hijas constan de fragmentos de la cadena antigua y fragmentos de la nueva.
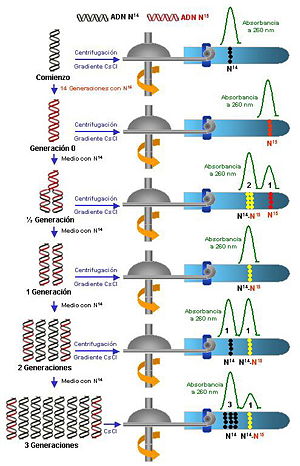
El experimento de Meselson y Stahl en 1958 permitió demostrar que el mecanismo real se ajusta a la hipótesis de replicación semiconservadora. Para ello se hicieron crecer células de Escherichia coli en presencia de nitrógeno-15, un isótopo del nitrógeno más pesado de lo habitual. En consecuencia, el isótopo se incorporó a las cadenas de ADN que se iban sintetizando, haciéndolas más pesadas.
Una vez conseguido el primer objetivo, las células fueron transferidas a un medio que contenía nitrógeno-14, es decir, un medio más ligero, donde continuaron su crecimiento (división celular, que requiere la replicación del ADN). Se purificó el ADN y se analizó mediante una centrifugación en gradiente de cloruro de cesio, en donde hay más densidad en el fondo del tubo que en la parte media del mismo.
En la primera generación (figura 2.b) se obtuvo una única banda de ADN con densidad intermedia. En la segunda generación (figura 2.c) se obtuvieron dos bandas, una con densidad ligera y otra con densidad intermedia o híbrida. En la tercera generación se obtuvieron dos bandas, una ligera (con una abundancia del 75%) y otra intermedia (con el 25% restante).
La banda intermedia o híbrida representa una molécula de ADN que contiene una cadena pesada (original) y otra ligera (recién sintetizada). Las cadenas ligeras representan una molécula de ADN en la que las dos cadenas han sido sintetizadas (no existían aun cuando las células se pusieron en presencia de nitrógeno-15.
El hecho de que cada vez haya más moléculas ligeras y se mantenga el número de moléculas intermedias demuestra que la replicación del ADN es semiconservadora. Si fuera conservadora, aparecería siempre una banda pesada y el resto ligeras (figuras 1.a, 1.b, 1.c) . Si fuera dispersante sólo aparecerían bandas híbridas de densidad intermedia en todas las generaciones.
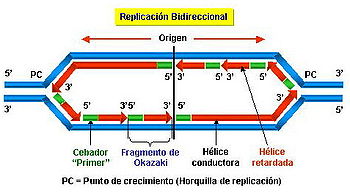
Secuencial y bidireccional desde puntos fijos.
Los orígenes de replicación son los puntos fijos que están a partir de los cuales se lleva cabo la replicación, que avanza de forma secuencial formando estructuras con forma de horquilla. Por otro lado, la replicación se lleva a cabo bidireccionalmente, es decir, a partir de cada origen se sintetizan las dos cadenas en ambos sentidos
El Origen de la Replicación
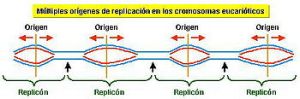
La cantidad de ADN que se puede sintetizar a partir de un único origen de replicación se denomina replicón o unidad funcional de replicación. El genoma bacteriano es un replicón único circular. En organismos eucarióticos, la replicación del ADN se inicia en múltiples orígenes a la vez (hay uno cada 20 kb aproximadamente), es decir, hay varios replicones.
Los experimentos realizados por Cairns (1963) con bacterias Escherichia coli permitieron determinar la existencia de ese punto fijo u origen de replicación a partir del cual el genoma empezaba a replicarse. Los experimentos consistían en mantener un cultivo de E. coli creciendo en un medio que contenía timidina tritiada (timina marcada con tritio), de forma que el ADN quedara marcado radiactivamente pudiendo efectuarse una autorradiografía. A continuación se observaba al microscopio. Los resultados indicaban que la replicación en E. coli se iniciaba en un punto concreto (OriC).
La replicación avanza en forma de horquilla
Debido a que en la célula ambas cadenas de la doble hélice de ADN se duplican al mismo tiempo, éstas deben separarse para que cada una de ellas sirva de molde para la síntesis de una nueva cadena. Por eso, la replicación avanza con una estructura en forma de horquilla formándose una burbuja u ojo de replicación (también llamada estructura θ cuando el ADN es circular debido a la similaridad entre la letra griega y la forma que adopta el cromosoma bacteriano en estados intermedios de replicación, no obstante pudiendo aparecer estructuras alternativas),[3] que avanza en dirección a la región de ADN no duplicado dejando atrás los dos moldes de ADN de cadena simple donde se está produciendo la replicación.
Bidireccionalidad
El movimiento de la horquilla es bidireccional en la mayoría de los casos, es decir, a partir de un punto se sintetizan las dos cadenas en ambos sentidos. Esto ocurre en la mayoría de los organismos, pero se dan excepciones en algunos procariontes debido a que los mecanismos de replicación que tienen lugar dependen de la propia estructura de su material hereditario (si el ADN es circular, lineal, bicatenario o monocatenario).[3] Así, en casos particulares como el ADN mitocondrial, algunos plásmidos y algunos genomas monocatenarios de fagos pequeños, la replicación se da unidireccionalmente pudiendo haber uno o dos orígenes de replicación.
No obstante, la replicación se puede considerar, de forma general, bidireccional.
La evidencia experimental del crecimiento bidireccional de la hebra de ADN viene dada por una técnica basada en el marcaje radiactivo del ADN usando timidina marcada con tritio. Primero se añade timidina marcada y luego sin marcar, y siguiendo el rastro de tritio se observa hacia dónde se ha replicado la molécula de ADN.[3] También se puede, mediante el recuento de copias de genes marcadores, determinar si la replicación es unidireccional o bidireccional. Otras técnicas se basan en medir la distancia desde los ojos de replicación hasta los extremos de un ADN lineal (o circular convertido en lineal mediante enzimas de restricción)
Bibliografía
* Bramhill, D., and Kornberg, A. 1988. A model for initiation at origins of DNA replication. Cell 54:915-18.